Курение сигарет, которое практикуют более миллиарда жителей нашей планеты, считается сегодня основной причиной болезней, от которых ежегодно умирает более шести миллионов человек. Многие курильщики не бросают курить (хотя были бы рады это сделать), потому что обеспокоены перспективой значительного увеличения веса после отказа от курения.
Надо сказать, что точная причина ожирения у тех, кто бросает курить, до сих пор неясна - исследования показывают, что, несмотря на распространенное мнение, большинство тех, кто перестает курить, не начинают больше есть. При этом в среднем после отказа от курения набор веса составляет 4,5 кг в течение первых 6–12 месяцев, а 13% бросивших курить за первый год набирают более 10 кг.
И вот теперь израильские ученые из научного института им. Вейцмана в Реховоте утверждают по итогам исследования на мышах, что увеличение веса у "пост-курильщиков" может быть вызвано соединениями, модулирующими вес, выделяемыми кишечными микробами. Результаты исследования опубликованы в журнале Nature.
«Наши результаты показывают, как организм-хозяин и его микробиом становятся партнерами в регулировании веса и обмена веществ», — говорит профессор Эран Элинав с отделения иммунологии Института Вейцмана, возглавлявший исследовательскую группу. «Соединения, которые мы идентифицировали, могут открыть путь к новым методам лечения, которые помогут тем, кто бросит курить, не набирать вес. Более того, они могут быть использованы в будущем для лечения ожирения даже среди некурящих».
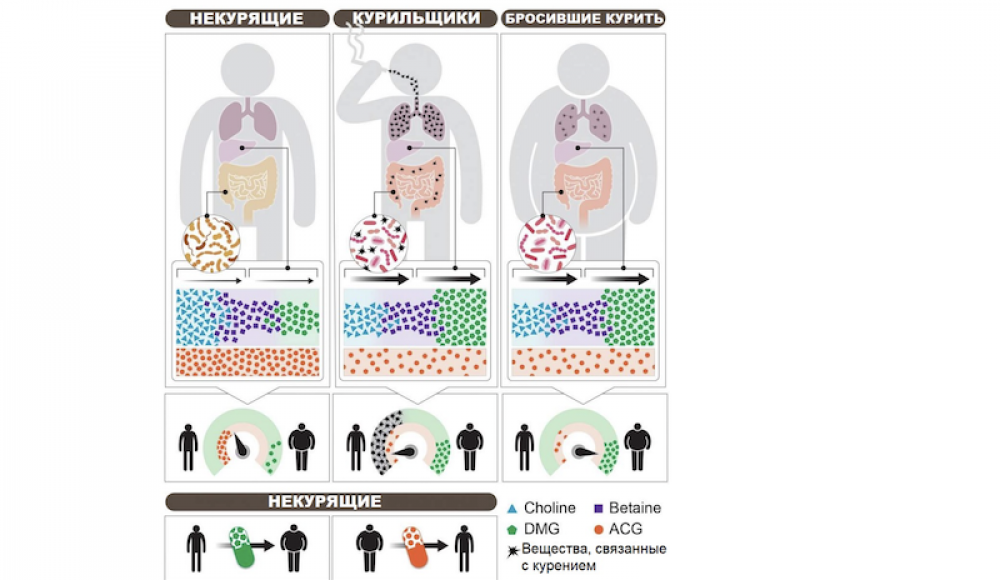
Исследователи обнаружили, что мыши, которые регулярно подвергались воздействию сигаретного дыма, не набирали вес, несмотря на то, что потребляли пищу с высоким содержанием жира и сахара. Когда же воздействие дыма прекратилось, мыши быстро потолстели - совсем как люди, бросающие курить. Однако, когда мышам дали антибиотики широкого спектра действия, которые истощали их микробиом (в первую очередь микрофлору кишечника), они набирали гораздо меньше веса после «отказа от курения», сохраняя стройность фигуры в течение нескольких месяцев независимо от диеты. Очевидно, связанные с курением соединения, такие, как никотин, проникали в кишечник «курящих» мышей из кровотока, тем самым меняя бактериальный состав кишечника и влияя на обмен веществ в организме.
Чтобы подтвердить, что именно кишечные микробы "виноваты" в прибавке веса у мышей, переставших вдыхать табачный дым, исследователи собрали микробиомы у «курящих» и «бросивших курить» мышей, и перенесли их на стерильных мышей, которые никогда не подвергались воздействию сигаретного дыма. У мышей-реципиентов развился микробный дисбаланс, подобный наблюдаемому у «курящих» мышей, а мыши, получившие дозу кишечных микробов животных, "бросивших курить", постепенно набрали вес. И в этом случае введение антибиотиков до пересадки микробиома привело к существенному снижению набора веса.
Из тысяч потенциально биоактивных метаболитов, генерируемых или изменяемых микрофлорой кишечника при воздействии табачного дыма, исследователи выделили две небольшие молекулы, которые могут объяснить метаболические последствия отказа от курения. Одна из них - это диметилглицин (DMG), метаболит, который микрофлора и печень производят из важного для здоровья вещества холина, поступающего в организм с пищей. Производство DMG увеличивалось при активном воздействии сигаретного дыма, но существенно снижалось, когда кишечный микробиом «курящих» мышей истощался антибиотиками. Когда этим мышам давали добавку DMG и убирали табачный дым, их способность набирать вес возвращалась. Судя по всему, DMG увеличивает "энергетический урожай" - объем получаемой с пищей энергии, потребляемой организмом. Когда мышей кормили диетой с дефицитом холина, то есть без "сырья" для производства DMG, они не набирали вес после прекращения "пассивного курения".
Второй биоактивный метаболит, ацетилглицин (ACG), давал по сравнению с DMG обратное действие: его уровни снижались во время активного воздействия дыма, а после прекращения "курения" повышались после лечения антибиотиками. Когда "бросившие курить" мыши (которые обычно имеют низкий уровень ACG) получали добавку этого метаболита, они не набирали вес после «прекращения курения».
Исследователи также показали, что эти две молекулы способны изменять вес даже у тех, кто не курил вообще. Введение DMG «некурящим» мышам приводило к умеренному увеличению веса, тогда как добавление ACG вызывало значительную потерю веса у некурящих мышей с ожирением в сочетании с улучшением некоторых других метаболических параметров. Геномный анализ жировой ткани мышей показал, что DMG и ACG дают противоположные эффекты — один активирует генетическую программу, связанную с ожирением, а другой — программу, связанную с потерей веса. Дополнительные исследования помогут выяснить механизмы, с помощью которых эти молекулы влияют на метаболизм млекопитающих.
В заключение исследователи взяли пробы микрофлоры у 96 курящих и некурящих людей - и обнаружили заметные изменения в микробиоме курильщиков, а также изменения микробных метаболитов, которые были аналогичны обнаруженным у «курящих» мышей, включая повышенный уровень DMG и его промежуточных продуктов. Дальнейшие исследования покажут, способствуют ли эти или другие метаболиты, производимые микробами нашего кишечника под воздействием продуктов курения, увеличению веса после того, как мы бросаем курить.
«Глубокое воздействие, которое наши микроскопические "жильцы" оказывают на наш организм, не перестает нас удивлять», — говорит проф. Элинав. «Наша работа проливает новый свет на то, как микробиом взаимодействует с человеческим телом в регулировании нашего веса и метаболизма такими способами, которые могут быть использованы в терапевтических целях».